
肿瘤免疫治疗通过激活自身免疫系统来识别和消灭癌细胞,其中免疫检查点抑制剂(immune checkpoint inhibitors, ICI)松开免疫细胞的“刹车”,让它们能全力攻击肿瘤;例如PD-1/PD-L1特异性抗体已在超过10种肿瘤适应症中成为一线疗法,造福大量患者[1]。但以中国发病率最高的非小细胞肺癌为例,仍有超过 60% 的病人对免疫疗法不应答[2]。究其根本,肿瘤细胞通过下调抗原呈递机制成功“隐身”,导致特异性T细胞无法识别,形成了典型的“冷肿瘤”。近年来,科学家们尝试将肿瘤的异常蛋白制成疫苗,让免疫系统学习肿瘤的特征。然而,这些方法无法破解肿瘤的“隐身”状态,并且受限于患者间肿瘤特征的高度异质性。
2026年1月7日,深圳湾实验室/北京大学陈鹏/张衡团队联合席建忠课题组在Nature上发表题为Intratumoural vaccination via checkpoint degradation-coupled antigen presentation的研究论文。该团队在前期系统发展膜蛋白靶向降解(meTPD)技术体系的基础上,着眼于将蛋白降解途径与抗原呈递通路在癌细胞内紧密耦合,成功利用meTPD技术,在解除免疫“刹车”的同时,迫使癌细胞呈递在人体中普遍存在的高质量抗原。这种以肿瘤为出发点的“降解型疫苗”为克服癌症的免疫耐受提供了新的解决策略。

打破僵局:癌症疫苗的新选择
首先,膜蛋白和胞外蛋白靶向降解技术(meTPD)的快速发展为这一构想奠定了基础[3]。2021年陈鹏团队在国际上率先开发了一种“非内吞受体依赖型”的膜蛋白降解平台:GlueTAC[4],可实现免疫检查点蛋白PD-L1的特异性清除。在此基础上,团队注意到,一些膜蛋白在被该技术降解的同时,其下游的抗原加工与呈递通路也会被激活。基于此,他们设计了一种能同时实现“免疫检查点降解”和“高质量抗原递送”的双功能嵌合体,进而改变了肿瘤与免疫系统之间的识别范式,将癌症疫苗的抗原选择从内源蛋白拓展至外源物质。另一方面,肿瘤微环境中虽然缺乏功能正常的肿瘤特异性T细胞,却存在不少“旁观者T细胞”,比如在流行病感染后产生的记忆型T细胞。这些“旁观者T细胞”虽然无法直接识别肿瘤,但如果癌细胞被迫呈递出与病原体相同的抗原,这些沉睡的免疫战士就能被唤醒,从“旁观”到“参战”,在患者体内建立长效的抗肿瘤免疫响应。
降解赋能:从“隐身敌军”到“情报信使”
传统的免疫疗法在肿瘤特异性T细胞的产生激活和效应杀伤阶段面临着双重困境:一方面,树突状细胞 (DCs) 等抗原呈递细胞 (APCs) 在肿瘤微环境中数量和功能均受限,难以训练出充足的T细胞;另一方面,癌症疫苗在淋巴结中诱导产生的T细胞与微环境中实际存在的抗原脱节,易产生耐药性。因此,理想的情况是让癌细胞行使与抗原呈递细胞类似的功能,既能利用肿瘤原位的抗原训练出正确的T细胞,又能在高质量抗原的帮助下长效激活T细胞,实现肿瘤清除。
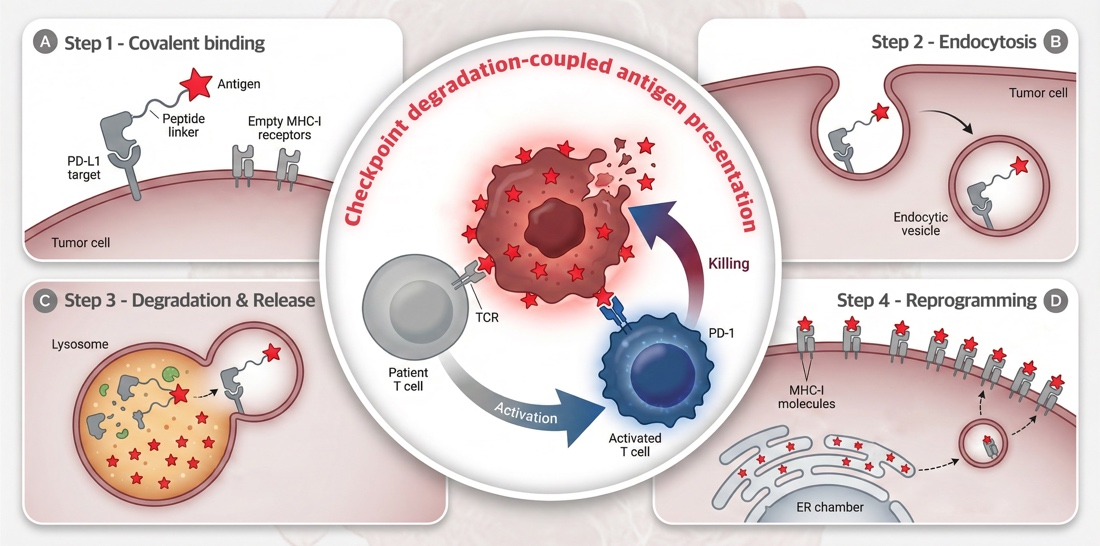
图1 瘤内疫苗嵌合体iVAC同时实现“免疫检查点降解”和“高质量抗原递送”
在生理条件下,APCs依赖模式识别受体 (PRR) 来摄取抗原,而以GlueTAC为代表的meTPD技术可以突破这一限制,在实现膜蛋白靶向降解的同时充当递送载体,向不表达PRR的肿瘤递送抗原,并迫使癌细胞主动摄取、加工甚至呈递这些抗原。为实现这一目标,团队设计了膜蛋白靶向降解驱动的“瘤内疫苗嵌合体” (Intratumoural vaccination chimera, iVAC)。通过化学生物学手段,iVAC分子的三大元件被整合在同一个分子上,分子量仅为18kDa,拥有良好的实体瘤浸润性。它们分别是:能高效富集于癌症病灶的共价型PD-L1纳米抗体、能触发胞吞的降解子、能高效释放抗原的免疫肽段。这一设计成功实现了一场细胞层面的“特洛伊木马”行动,将原本抑制免疫响应的癌细胞,转化为类似树突细胞的免疫系统信使。这一过程被称为“免疫检查点降解耦联的抗原呈递”(Checkpoint degradation-coupled antigen presentation)。研究结果表明,经iVAC分子“重编程”的癌细胞能够高效激活抗原特异性CD8+T细胞,其效果甚至与骨髓来源的树突状细胞 (BMDCs) 相当。这些“被免疫”的癌细胞不仅拥有更丰富的MHC-I分子,还能在接触 T 细胞后显著上调其细胞活化标记物 (CD69、CD25、CD44) 和细胞毒性分子 (GZB、PFN) ,并促进 T 细胞分泌细胞因子 (IFNγ、TNFα),形成了免疫响应的正反馈循环。
临床潜力:唤醒体内的"沉睡军团"
在实际应用中,iVAC分子所递送的抗原需要在广泛的癌症患者群体中具有响应性。基于这一需求,全球感染率超过80%的巨细胞病毒 (cytomegalovirus, CMV) 进入了团队的视野[5]。由于CMV引起的感染常被人体自愈,多数人在不知不觉中便拥有了针对CMV抗原的记忆型T细胞。这些CMV特异性T细胞在人体内处于“沉睡”状态,数量庞大但无法识别肿瘤。负载了CMV抗原的iVAC分子如同一把特殊的“钥匙”,可以在肿瘤原位精准唤醒这支“沉睡军团”。
在多种癌症模型中,iVAC分子成功激活了人源的CMV特异性T细胞,实现了对三阴性乳腺癌等肿瘤的高效杀伤。不仅如此,iVAC分子在移植肿瘤的人源化小鼠中显著抑制了肿瘤生长。与单独使用免疫检查点阻断疗法相比,iVAC展现出更强的抗肿瘤效果。此外,在临床病人来源的肿瘤类器官模型中,iVAC分子展现出同样的功效:iVAC有效激活了十余例不同癌症患者体内的记忆型T细胞,成功实现对自体肿瘤的杀伤。这一结果进一步显示了该技术在肿瘤免疫治疗中的巨大潜力。
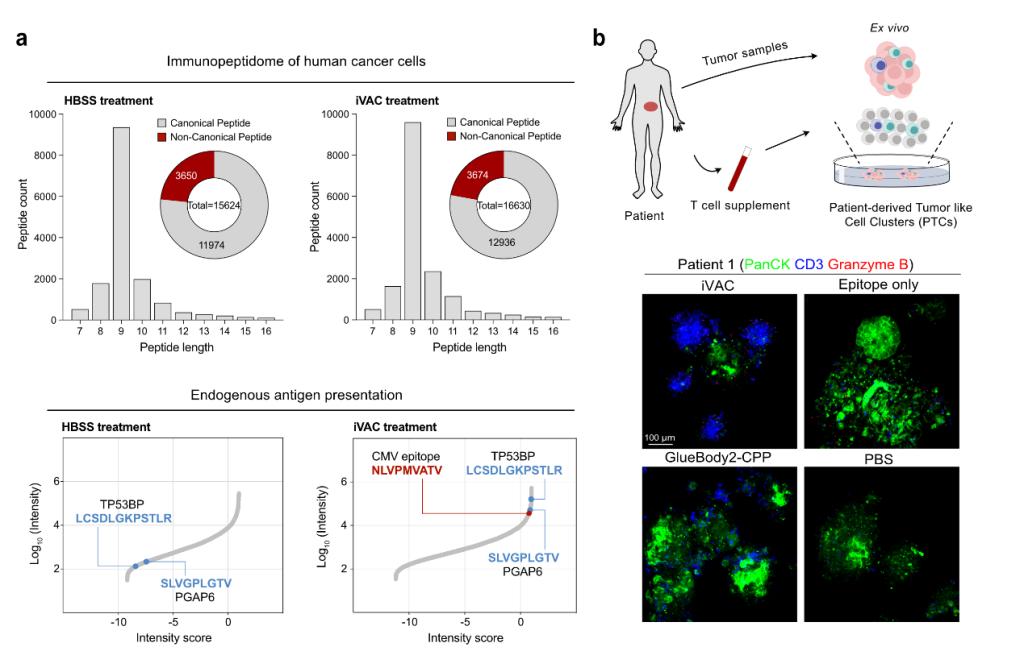
图2 瘤内疫苗嵌合体iVAC增强人肿瘤细胞的CMV抗原和内源抗原呈递(a)并在类器官模型中介导旁观者T细胞对肿瘤细胞的杀伤(b)
当前,膜蛋白与胞外蛋白靶向降解技术(meTPD)正在高速发展,不仅需要拓展传统的靶向蛋白降解(TPD)领域的范畴,更需要通过功能创新开辟出“降解+”的全新应用维度。在寻找可降解蛋白靶点和内吞转运的细胞表面受体之外,陈鹏团队最新的工作,将meTPD技术与癌症疫苗策略深度融合,实现了“膜蛋白降解耦联的抗原呈递”这一独特机制,在肿瘤原位完成“疫苗接种”,为整个蛋白质靶向降解领域开拓了新的应用场景。
通过将肿瘤细胞“重编程”为具有类似APC功能的“疫苗载体”,抗原的选择就不再局限于有限且多变的肿瘤特异性蛋白。这一将病毒抗原嫁接给癌细胞的 “移花接木”的思路,“巧妙调用”机体固有的抗病毒免疫资源,为破解肿瘤免疫原性低、特异性T细胞不足等临床难题提供了新的路径,提供了一种更具普适性的癌症疫苗开发新范式。目前,研究团队正积极推进其临床转化研究,力争尽早为癌症患者带来新的治疗希望。
深圳湾实验室陈鹏资深研究员、深圳湾实验室张衡副研究员和北京大学席建忠教授为本文的共同通讯作者。北京大学前沿交叉学科研究院博士后韩雨博士、博士生马毅骢、深圳医学科学院/西湖大学联培博士生裴苗为本文的共同第一作者。清华大学徐萌课题组为本工作的T细胞实验提供了专业帮助;深圳湾实验室李子刚课题组和李茂课题组在小鼠免疫接种方面提供了大力支持。
本工作获得深圳湾实验室重大项目、科技部、国家自然科学基金委、全国博士后管理委员会办公室、中国博士后科学基金会、北京市科学技术委员会、北京分子科学国家研究中心、新基石科学基金会和科学探索奖等项目的支持。

参考文献
1.Hossain, M. A. A comprehensive review of immune checkpoint inhibitors for cancer treatment.Int. Immunopharmacol.143, 113365, doi: 10.1016/j.intimp.2024.113365 (2024).
2.Zhou, S. A. & Yang, H. H. Immunotherapy resistance in non-small-cell lung cancer: From mechanism to clinical strategies.Front. Immunol.14, 1129465, doi:10.3389/fimmu.2023.1129465 (2023).
3.Zhu, R. F., Zhang, H. & Chen, P. R. Targeted protein degradation in the transmembrane and extracellular space.Science390, eadx5094, doi:10.1126/science.adx5094 (2025).
4.Zhang, H. et al. Covalently Engineered Nanobody Chimeras for Targeted Membrane Protein Degradation.J. Am. Chem. Soc.143, 16377-16382, doi:10.1021/jacs.1c08521 (2021).
5.Zuhair, M. et al. Estimation of the worldwide seroprevalence of cytomegalovirus: A systematic review and meta-analysis.Rev. Med. Virol.29, e2034, doi:10.1002/rmv.2034 (2019).
原文信息:
Intratumoural vaccination via checkpoint degradation-coupled antigen presentation
文章来源|陈鹏课题组
编辑|鲍 啦
责编|远 山
欢迎投稿、建议|media@szbl.ac.cn

 粤公网安备44031102000926号
粤公网安备44031102000926号