
程序性细胞死亡是宿主抵御病原体感染的重要免疫手段,病毒感染常引起的程序性细胞死亡包括凋亡、焦亡以及程序性细胞坏死。研究显示,过度的细胞凋亡可以显著抑制新冠病毒复制【1】,出人意料地,抑制细胞凋亡同样也能抑制新冠病毒复制【2, 3】,暗示新冠病毒能够调控程序性细胞死亡的活化过程以帮助自身复制;然而,这背后的调控机制还鲜有研究。
近日,深圳湾实验室传染病研究所郑敏课题组、刘洋课题组与香港大学陈鸿霖课题组合作在Advanced Science杂志上发表了题为The NSP5, ORF6 and NSP13 of SARS-CoV-2 Cooperate to Modulate Inflammatory Cell Death Activation的研究,系统地阐述了冠状病毒如何调控ZBP1所介导的程序性细胞死亡过程。

作为Z型核酸(Z-form nuclei acid, Z-NA)受体,ZBP1结合Z-NA后可以激活程序性细胞死亡通路。2016年,Kanneganti课题组【4】和Balachandran课题组【5】先后发现ZBP1能够识别流感病毒感染而诱导细胞死亡。随着进一步的深入研究,Kanneganti课题组发现流感病毒感染巨噬细胞可以同时激活凋亡、焦亡以及程序性细胞坏死,且该过程由ZBP1控制,因此,他们称这种细胞死亡为PANoptosis(潘亡)。2020年,Balachandran课题组发现流感病毒复制过程中产生的缺陷型基因组能够产生Z型构象,从而被ZBP1的Zα结构域识别【6】。2022年, Kanneganti课题组发现冠状病毒感染也能激活ZBP1介导的PANoptosis【7】。2023年,武汉病毒所彭珂课题组发现新冠病毒能在复制过程中产生Z型RNA,从而激活ZBP1【8】。目前,除了流感病毒和冠状病毒,已经发现的能被ZBP1识别的病毒还有鼠巨细胞病毒(MCMV),单纯疱疹病毒1型(HSV-1)以及痘苗病毒(Vaccinia Virus)。这其中,MCMV和HSV-1编码了含有RHIM(RIP homotypic interaction motif)结构域的蛋白,可以有效抑制ZBP1经由自身RHIM招募下游接头蛋白(RIPK3、RIPK1)的过程,而痘苗病毒则编码了含有Zα结构域的蛋白,从而拮抗ZBP1对Z-NA的识别。然而,作为基因组最大的RNA病毒,冠状病毒是如何抑制ZBP1介导的细胞死亡呢?
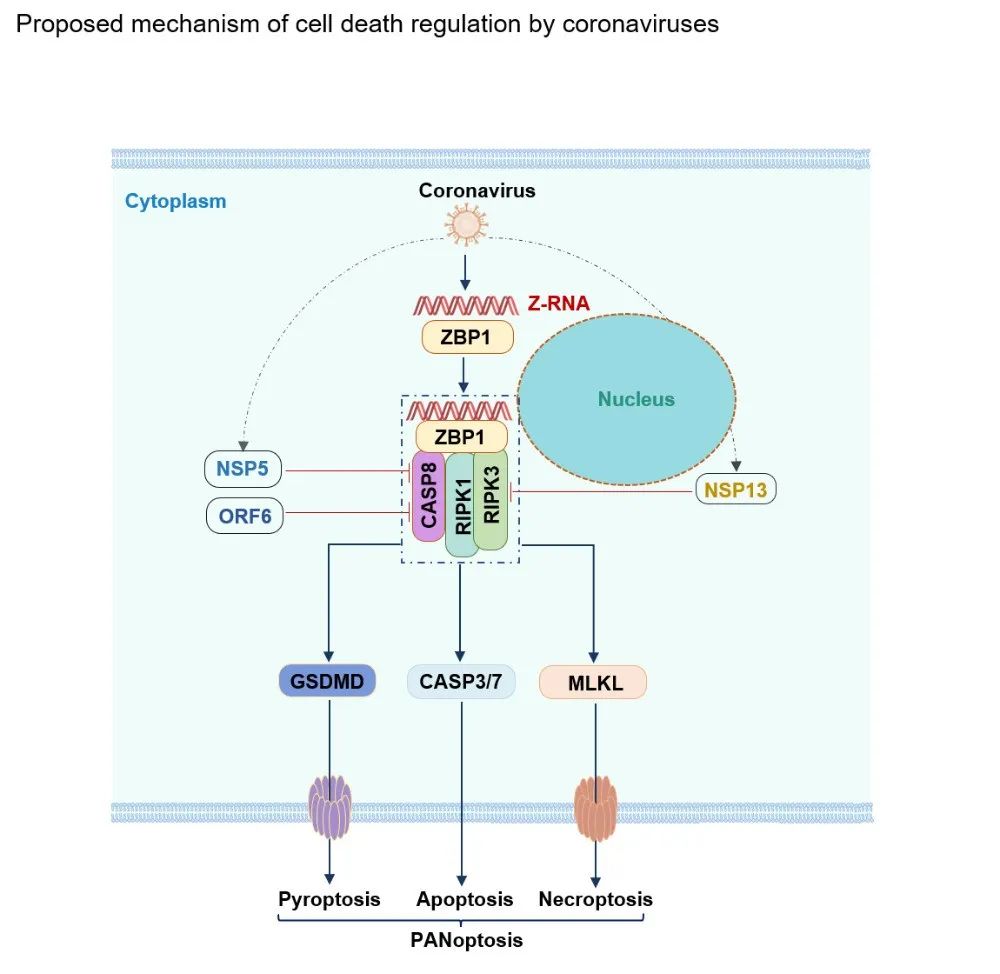
在最新发表的文章中,郑敏课题组发现,冠状病毒感染呼吸道上皮细胞后,Z型核酸能够与ZBP1、RIPK3和caspase-8形成斑点复合物,且确实能够激活ZBP1介导的PANoptosis。在这一过程中,caspase-8的蛋白酶活性对凋亡和焦亡的发生至关重要,而RIPK3的激酶活性则是程序性细胞坏死所必须的。通过筛选,郑敏团队发现新冠病毒编码的NSP5和ORF6蛋白能够分别与caspase-8的大小亚基结合而抑制其酶切活性,而NSP13蛋白则能够与ZBP1竞争性结合RIPK3,从而抑制程序性细胞坏死的发生。因此,郑敏团队发现新冠病毒能够通过不同的蛋白调控ZBP1介导的细胞死亡活化(见示意图),为阐明其致病机制提供了新的思路。新冠疫情期间的临床研究显示,流感病毒和新冠病毒共感染者的死亡率显著高于单一新冠病毒感染者,单机制未明。郑敏团队通过建立小鼠共感染模型发现,冠状病毒对PANoptosis的抑制能够显著促进流感病毒的复制,并增强共感染过程中炎症性细胞因子的表达,为相关临床发现提供了可能的解释。
这项工作由深圳湾实验室传染病研究所王欢博士和梁梦迪同学(香港大学联培博士生)共同担任第一作者。深圳湾实验室传染病研究所刘洋博士和香港大学李嘉诚医学院陈鸿霖教授担任共通讯作者。山东大学王培会教授参与了本研究,并提供了重要帮助。
深圳湾实验室郑敏课题组致力于研究感染与非感染过程中,Z型核酸(左手螺旋核酸)形成所引起的相关疾病(如肺炎、癌症以及自身免疫性疾病)的发生机制。郑敏课题组正主持国家级青年人才项目、国自然面上项目以及科技部重大专项子课题项目等。郑敏课题组热忱欢迎有激情、有好奇心且乐于拼搏的博士后、博士加入团队。详见:https://www.szbl.ac.cn/research/group/Min-Zheng.htm
参考文献
1.Nelli, R.K., Phadke, K.-S., Castillo, G., Yen, L., Saunders, A., Rauh, R., Nelson, W., Bellaire, B.H., and Giménez-Lirola, L.G. (2021). Enhanced apoptosis as a possible mechanism to self-limit SARS-CoV-2 replication in porcine primary respiratory epithelial cells in contrast to human cells.Cell Death Discov.7, 1–10. https://doi.org/10.1038/s41420-021-00781-w.
2.Chu, H., Shuai, H., Hou, Y., Zhang, X., Wen, L., Huang, X., Hu, B., Yang, D., Wang, Y., Yoon, C., et al. (2021). Targeting highly pathogenic coronavirus-induced apoptosis reduces viral pathogenesis and disease severity.Sci. Adv.7, eabf8577. https://doi.org/10.1126/sciadv.abf8577.
3.Chu, H., Hou, Y., Yang, D., Wen, L., Shuai, H., Yoon, C., Shi, J., Chai, Y., Yuen, T.T.-T., Hu, B., et al. (2022). Coronaviruses exploit a host cysteine-aspartic protease for replication.Nature609, 785–792. https://doi.org/10.1038/s41586-022-05148-4.
4.Kuriakose, T., Man, S.M., Malireddi, R.K.S., Karki, R., Kesavardhana, S., Place, D.E., Neale, G., Vogel, P., and Kanneganti, T.-D. (2016). ZBP1/DAI is an innate sensor of influenza virus triggering the NLRP3 inflammasome and programmed cell death pathways.Sci. Immunol.1, aag2045. https://doi.org/10.1126/sciimmunol.aag2045.
5.Thapa, R.J., Ingram, J.P., Ragan, K.B., Nogusa, S., Boyd, D.F., Benitez, A.A., Sridharan, H., Kosoff, R., Shubina, M., Landsteiner, V.J., et al. (2016). DAI Senses Influenza A Virus Genomic RNA and Activates RIPK3-Dependent Cell Death.Cell Host Microbe20, 674–681. https://doi.org/10.1016/j.chom.2016.09.014.
6.Zhang, T., Yin, C., Boyd, D.F., Quarato, G., Ingram, J.P., Shubina, M., Ragan, K.B., Ishizuka, T., Crawford, J.C., Tummers, B., et al. (2020). Influenza Virus Z-RNAs Induce ZBP1-Mediated Necroptosis.Cell180, 1115-1129.e13. https://doi.org/10.1016/j.cell.2020.02.050.
7.Karki, R., Lee, S., Mall, R., Pandian, N., Wang, Y., Sharma, B.R., Malireddi, R.S., Yang, D., Trifkovic, S., Steele, J.A., et al. (2022). ZBP1-dependent inflammatory cell death, PANoptosis, and cytokine storm disrupt IFN therapeutic efficacy during coronavirus infection.Sci. Immunol.7, eabo6294. https://doi.org/10.1126/sciimmunol.abo6294.
8.Li, S., Zhang, Y., Guan, Z., Ye, M., Li, H., You, M., Zhou, Z., Zhang, C., Zhang, F., Lu, B., et al. (2023). SARS-CoV-2 Z-RNA activates the ZBP1-RIPK3 pathway to promote virus-induced inflammatory responses.Cell Res.,1–14. https://doi.org/10.1038/s41422-022-00775-y.
原文信息:
The NSP5, ORF6 and NSP13 of SARS-CoV-2 Cooperate to Modulate Inflammatory Cell Death Activation
文章来源|BioArtMED
编辑|鲍 鲍
责编|远 山
欢迎投稿、建议|media@szbl.ac.cn

 粤公网安备44031102000926号
粤公网安备44031102000926号